Năm 1869, nhà hóa học người Nga Dmitri Mendeleev đề xuất rằng các nguyên tố hóa học thể hiện một "tính tuần của các tính chất". Ông cố gắng sắp xếp các nguyên tố theo trọng lượng nguyên tử, giả định rằng tính chất của các nguyên tố sẽ dần dần thay đổi khi trọng lượng nguyên tử tăng lên. Tuy nhiên, điều mà ông phát hiện ra là các tính chất vật lý và hóa học của các nguyên tố tăng dần rồi đột ngột thay đổi theo các giai đoạn rõ rệt. Để giải thích cho những xu hướng lặp lại này, Mendeleev đã nhóm các nguyên tố trong một bảng có cả hàng và cột.
.jpg)
Bảng tuần hoàn hóa học hiện đại là gì?
Bảng tuần hoàn hóa học hiện đại dựa trên các quan sát của Mendeleev. Tuy nhiên, thay vì được sắp xếp theo trọng lượng nguyên tử, bảng hiện đại được sắp xếp theo số nguyên tử (z).
Khi di chuyển từ trái sang phải trong một hàng của bảng tuần hoàn, tính chất của các nguyên tố dần dần thay đổi. Ở cuối mỗi hàng, một sự thay đổi mạnh mẽ xảy ra trong tính chất hóa học. Phần tử tiếp theo theo thứ tự số nguyên tử tương tự hơn (về mặt hóa học) với phần tử đầu tiên ở hàng trên nó; do đó, một hàng mới bắt đầu.
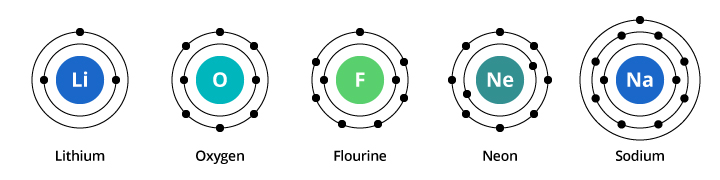
Ví dụ: oxy (O), flo (F) và neon (Ne) (z = 8, 9 và 10, tương ứng) đều là những phi kim ổn định ở dạng khí ở nhiệt độ phòng. Tuy nhiên, natri (Na, z = 11) là một kim loại bạc ở thể rắn ở nhiệt độ phòng, giống như nguyên tố liti (z = 3). Do đó, natri bắt đầu một hàng mới trong bảng tuần hoàn và được đặt ngay bên dưới liti, làm nổi bật những điểm tương đồng về mặt hóa học của chúng.
Các hàng trong bảng tuần hoàn được gọi là các chu kỳ. Khi di chuyển từ trái sang phải trong một chu kỳ nhất định, tính chất hóa học của các nguyên tố thay đổi dần dần. Các cột trong bảng tuần hoàn được gọi là nhóm. Các nguyên tố trong một nhóm nhất định trong bảng tuần hoàn có nhiều tính chất vật lý và hóa học giống nhau.
Cấu hình electron liên quan gì đến bảng tuần hoàn
Tính chất "tuần hoàn" của các tính chất hóa học mà Mendeleev đã khám phá ra có liên quan đến cấu hình electron các nguyên tố. Nói cách khác, cách mà các electron của nguyên tử được sắp xếp xung quanh hạt nhân của nó ảnh hưởng đến tính chất của nguyên tử.
Lý thuyết nguyên tử của Niels Bohr cho chúng ta biết rằng các electron không được định vị ngẫu nhiên xung quanh hạt nhân của nguyên tử, mà chúng xuất hiện trong các lớp vỏ electron cụ thể. Mỗi lớp vỏ có một khả năng chứa giới hạn cho các electron. Khi các lớp vỏ thấp hơn được lấp đầy, các electron bổ sung nằm trong các lớp vỏ xa hơn.
Giới hạn của lớp vỏ electron thứ nhất là hai electron và đối với lớp vỏ thứ hai, giới hạn là tám. Do đó, trong ví dụ của chúng ta đã thảo luận ở trên, oxy, với tám proton và tám electron, mang hai electron ở lớp vỏ thứ nhất và sáu ở lớp vỏ thứ hai. Flo, với 9 electron, mang 2 ở lớp thứ nhất và 7 ở lớp thứ hai. Neon, với mười electron, mang hai electron trong lớp vỏ thứ nhất và tám điện tử trong lớp electron thứ hai. Do số lượng electron trong lớp vỏ thứ hai tăng lên, chúng ta có thể bắt đầu hình dung tại sao các tính chất hóa học dần dần thay đổi khi chúng ta chuyển từ oxy sang flo rồi đến neon.
Natri có mười một electron. Hai cái phù hợp với lớp vỏ thứ nhất của nó, nhưng hãy nhớ rằng lớp vỏ thứ hai chỉ có thể mang tám electron. Electron thứ mười một của natri không thể vừa với lớp vỏ thứ nhất hoặc lớp thứ hai của nó. Electron này cư trú trong một quỹ đạo khác, lớp vỏ electron thứ ba trong natri. Sở dĩ có sự thay đổi mạnh mẽ về tính chất hóa học khi chuyển từ neon sang natri là do có sự thay đổi mạnh mẽ về cấu hình electron giữa hai nguyên tố. Nhưng tại sao natri tương tự như lithium? Hãy xem cấu hình electron của các nguyên tố này.
Như bạn có thể thấy trong hình minh họa, trong khi natri có ba lớp vỏ điện tử và liti có hai lớp, đặc điểm chung của chúng là cả hai đều chỉ có một điện tử ở lớp vỏ điện tử ngoài cùng. Các electron lớp ngoài cùng này (được gọi là các electron hóa trị) rất quan trọng trong việc xác định tính chất hóa học của các nguyên tố.
Tính chất hóa học của một nguyên tố được xác định bằng cách các nguyên tử của nó tương tác với các nguyên tử khác. Nếu chúng ta hình dung lớp vỏ electron (hóa trị) bên ngoài của một nguyên tử như một quả cầu bao gồm mọi thứ bên trong, thì chỉ lớp vỏ hóa trị mới có thể tương tác với các nguyên tử khác – giống như cách nó chỉ là lớp sơn bên ngoài ngôi nhà của bạn mà "tương tác" với, và bị ướt bởi nước mưa.
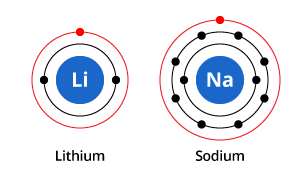
Các electron lớp vỏ hóa trị trong một nguyên tử xác định cách nó sẽ tương tác với các nguyên tử lân cận và do đó xác định tính chất hóa học của nó. Vì cả natri và liti đều có một điện tử hóa trị nên chúng có những tính chất hóa học tương tự nhau.
Kết luận
Bảng tuần hoàn hiện đại dựa trên các quan sát năm 1896 của Dmitri Mendeleev rằng các nguyên tố hóa học có thể được nhóm lại theo tính chất hóa học mà chúng thể hiện. Mô-đun này giải thích cách sắp xếp các nguyên tố trong bảng tuần hoàn. Nó xác định các chu kỳ và các nhóm và mô tả cách các cấu hình electron khác nhau ảnh hưởng đến tính chất của nguyên tử.
Bài viết liên quan:
Những tin cũ hơn
-
Tiểu sử tổng bí thư Trần Phú
(29/05/2017) -
Tiểu sử tổng bí thư Lê Hồng Phong
(29/05/2017) -
Tiểu sử tổng bí thư Hà Huy Tập
(29/05/2017) -
Tiểu sử tổng bí thư Nguyễn Văn Cừ
(29/05/2017) -
Tiểu sử tổng bí thư Trường Trinh
(29/05/2017) -
Tiểu sử tổng bí thư Lê Duẩn
(29/05/2017) -
Tiểu sử tổng bí thư Nguyễn Văn Linh
(29/05/2017) -
Tiểu sử tổng bí thư Đỗ Mười
(29/05/2017) -
Tiểu sử tổng bí thư Lê Khả Phiêu
(29/05/2017) -
Tiểu sử tổng bí thư Nông Đức Mạnh
(29/05/2017) -
Tiểu sử tổng bí thư Nguyễn Phú Trọng
(29/05/2017) -
Tiểu sử Chủ tịch Hồ Chí Minh
(29/05/2017)





